【通關監管】出口印度醫療器械須知
一、出口通關提示
1.商品歸類
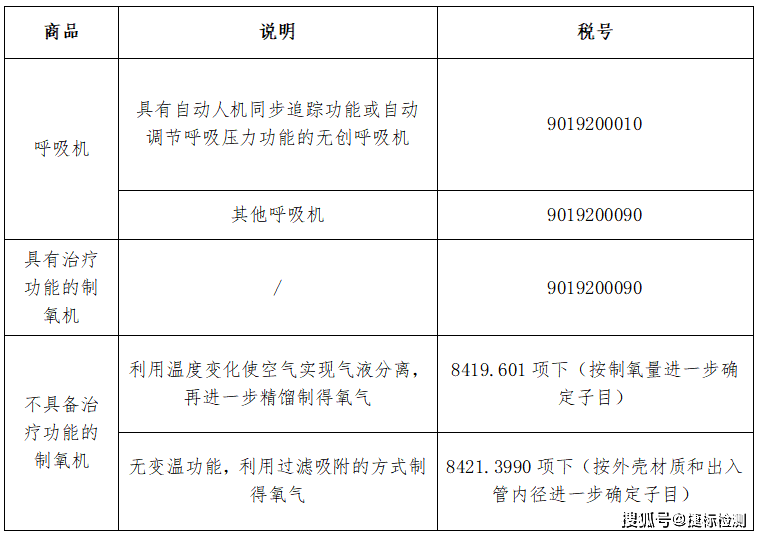
2.呼吸機出口時需具備的資質及材料
第一種情況:產品已取得我國醫療器械產品注冊證書,符合進口國(地區)的質量標準要求
根據《關于有序開展醫療物資出口的公告》(商務部 海關總署 國家藥品監督管理局公告2020年第5號)規定,出口呼吸機的企業向海關報關時,須提供書面或電子聲明,承諾出口產品已取得我國醫療器械產品注冊證書,符合進口國(地區)的質量標準要求,海關憑藥品監督管理部門批準的醫療器械產品注冊證書驗放。

第二種情況:產品取得國外標準認證或注冊
根據《關于進一步加強防疫物資出口質量監管的公告》(商務部 海關總署 國家市場監督管理總局公告2020年第12號)規定,產品取得國外標準認證或注冊的呼吸機出口企業,報關時須提交電子或書面聲明,承諾產品符合進口國(地區)質量標準和安全要求,海關憑商務部提供的國外標準認證或注冊的生產企業清單(清單在中國醫藥保健品進出口商會網站 www.cccmhpie.org.cn動態更新)驗放。
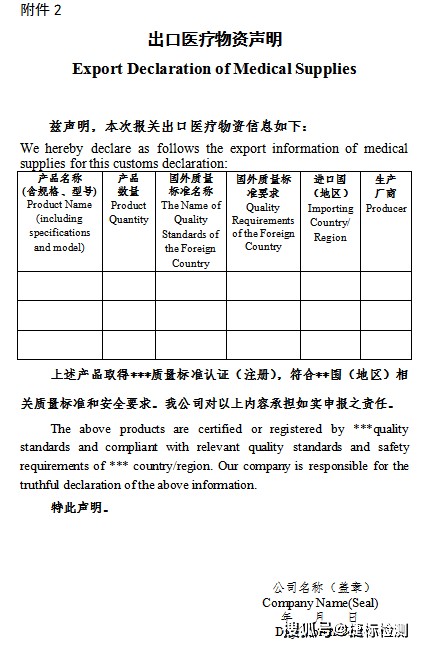
第三種情況:產品不屬于上述公告范圍
不屬于上述公告范圍內的呼吸機配件、制氧機等商品,不用按公告要求提供相關單證。但屬于醫療器械的,應遵守《醫療器械監督管理條例》(國務院令680號)要求,即:出口醫療器械的企業應當保證其出口的醫療器械符合進口國(地區)的要求。
3.出口退稅:本文歸類列表所列商品出口退稅稅率均為13%
二、印度醫療器械準入條件
1.印度醫療器械的監管機構
印度衛生和家庭福利部(Ministry of Health & FW)下的中央藥品標準控制局(Central Drug Standards Control Organization,簡稱CDSCO)為印度醫療器械的中央主管機構,其內部的重要組成機構印度藥品管理總局(The Drug Controller General of India,簡稱DCGI)作為印度全國醫療器械政策的制定單位。
2.醫療器械的分類
2017年印度對醫療器械法規進行了大幅修訂,公布了《醫療器械管理條例2017》(Medical Device Rules 2017),從2018年1月起實施,參照了“全球醫療器械法規調和會”(The Global Harmonization Task Force,簡稱GHTF),將醫療器械分為A到D四類,對應從低風險到高風險四種風險級別。

印度CDSCO在2017年也發布了《醫療器械與體外診療醫療器械分類標準》,印度要求在申請產品登記時,應遵循印度藥品管理總局(DCGI)針對醫療器械的分類決定。對于未能判斷分類的情況,應向CDSCO提出分類申請。
3.出口印度醫療器械制造許可證的申請
出口醫療器械至印度進行銷售或使用,必須經印度當地授權代理人(authorised agent)向CDSCO提出醫療器械進口許可證申請(包括A至D級)。CDSCO對醫療器械進口許可證的審核主要分為兩步:
第一步:確認生產企業質量管理體系(Quality Management System,簡稱QMS)的符合性
首先CDSCO審核授權代理人所提交的生產企業質量管理體系,其必須符合印度醫療器械質量管理標準ICMED 13485(修改采用自ISO 13485,我國標準YY/T 0287等效采用了ISO 13485),包括:生產企業QMS技術文件、檢測報告、最近一次現場檢查報告等,如果CDSCO認定生產企業QMS的符合存在疑慮時,可以要求實施評估、產品檢測或生產企業現場檢查(費用由代理人承擔)。
第二步:審核醫療器械的安全性與有效性
如果出口印度的醫療器械分類屬于A級或者B級,授權代理人應向CDSCO提交中國的自由銷售證明,或者中國實施臨床測試的數據(或其他可供證明產品安全性與有效性的數據)。如果出口印度的醫療器械分類屬于C級或者D級,授權代理人必須在印度實施臨床測試。
例外情況:如果醫療器械(A級至D級)已由歐盟、美國、加拿大、日本或澳大利亞的監管機構頒發了自由銷售證明,則無需再進行臨床測試。
4.醫療器械標簽
印度《醫療器械管理條例2017》第44條至48條對醫療器械的標簽進行了要求。
醫療器械標簽要求:該條例第44條規定,應用不可抹掉的墨水在醫療器械的架子包裝上或醫療器械的外殼上以及在包裝醫療器械的每個外殼上印刷以下內容。
01.醫療器械的名稱。
02.用戶識別設備及其使用所必需的細節。
03.制造商的名稱和制造該設備的制造場所的地址。
04.關于凈數量的正確說明,應以重量、尺寸、體積、單位數量(視情況而定)以及包裝中所含設備的數量以公制表示。
05.生產年月及有效期(或者標簽應標明產品的保質期)。
06.在需要時提供指示,以表明該器械含有藥用或生物物質。
07.提供一個明顯的批號,并以“Lot No.”一詞開頭或“Lot”或“Batch No.”或“B. No.”。
08.在需要時指出適用于該設備的任何特殊存儲或處理條件。
09.指明該裝置是否以無菌產品形式提供,及其無菌狀態和滅菌方法。
10.給予警告或預防措施(如果認為相關的話),以引起醫療器械使用者的注意。
11.如果該設備是一次性使用的,則應適當標記該設備。
12.如果打算將醫療器械作為免費樣品分發給醫療專業人員,則在該器械的標簽上套印“Physician’s Sample—Not to be sold”字樣。
13.除進口設備外,在“Manufacturing Licence Number”或“Mfg. Lic. No.” 或“M. L”之前加上制造許可證號。
14.如果是進口設備,則在標簽上通過粘貼方式提供(如果尚未打印)此類細節,包括:進口許可證編號、進口商的名稱和地址、實際生產場所的地址以及制造日期。
15.如果小型醫療器械因為體積原因,無法清晰打印所有信息,則至少應包括產品識別和安全所需的信息。例如:第1、2、3、4條款所涵蓋的信息,第5、7、11和13應包括在內。
唯一的器械標識:條例第46條規定,自2022年1月1日起,經批準制造、銷售、分銷或進口的醫療器械應帶有唯一的器械標識,其中應包含器械標識符和生產標識符。其中:
01.“器械標識符”是指全球貿易項目編號。
02.“生產標識符”是指序列號、批次或批號、醫療器械軟件版本號、制造日期和或有效期。
三、印度臨時性政策
印度財政部已于2021年4月24日發布第28/2021-Customs公告,取消制氧機(HS 9019/HS 842139) 、呼吸機(HS 9019)等18項產品進口關稅,至2021年7月31日止。具體內容請詳見公告原文(網址鏈接見二維碼)。
印度港口、航運暨水道部也于25日通知各主要港口,取消進口氧氣及相關設備的港口處理費,給予優先泊船通關。港務人員必須嚴格控制船舶入港及貨物通關時間,協助物流運作。
【來源:internet】


